آنتالپی سوختن چیست و چرا برای محیط زیست مهم است؟
آنتالپی سوختن چیست؟
آنتالپی سوختن (Enthalpy of Combustion) یکی از مفاهیم مهم در ترمودینامیک و شیمی فیزیک است که به مقدار انرژی گرمایی آزاد یا جذب شده در طی واکنش شیمیایی سوختن یک ماده در حضور اکسیژن اشاره دارد. این کمیت معمولاً به صورت تغییر آنتالپی (ΔH) برای یک مول از ماده در شرایط استاندارد (دمای 25 درجه سانتیگراد و فشار 1 اتمسفر) تعریف میشود و به صورت کیلوژول بر مول (kJ/mol) یا گاهی کیلوکالری بر مول گزارش میشود.
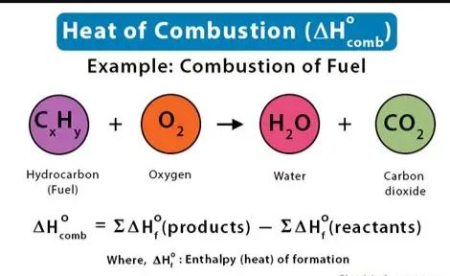
تعریف آنتالپی سوختن
آنتالپی سوختن به گرمای آزاد شده (یا در موارد نادر جذب شده) در طی یک واکنش شیمیایی اشاره دارد که در آن یک ماده (معمولاً یک سوخت مانند هیدروکربنها) به طور کامل با اکسیژن واکنش داده و به دیاکسید کربن (CO₂) و آب (H₂O) تبدیل میشود. این واکنش معمولاً به صورت اگزوترمیک (گرمازا) است، به این معنا که انرژی به صورت گرما به محیط منتقل میشود.
به عنوان مثال، واکنش سوختن متان (CH₄) به صورت زیر است:
CH₄(g) + 2O₂(g) → CO₂(g) + 2H₂O(l) ΔH = -890.3 kJ/mol
در این واکنش، برای هر مول متان که میسوزد، 890.3 کیلوژول انرژی گرمایی آزاد میشود.
انواع آنتالپی سوختن
آنتالپی استاندارد سوختن (ΔH_c°): این مقدار برای واکنشهایی تعریف میشود که در شرایط استاندارد (298 K و 1 atm) رخ میدهند و محصولات و واکنشدهندهها در حالت استاندارد خود (گاز، مایع یا جامد) هستند.
آنتالپی سوختن ناقص: در صورتی که سوختن به طور کامل انجام نشود (مثلاً به دلیل کمبود اکسیژن)، محصولاتی مانند مونوکسید کربن (CO) یا دوده (C) تشکیل میشوند که این واکنشها معمولاً انرژی کمتری آزاد میکنند.

اهمیت آنتالپی سوختن
کاربرد در صنعت انرژی: آنتالپی سوختن برای ارزیابی کارایی سوختها (مانند بنزین، گاز طبیعی یا زغالسنگ) استفاده میشود. سوختهایی با آنتالپی سوختن بالاتر، انرژی بیشتری تولید میکنند.
طراحی موتورها و سیستمهای گرمایشی: در مهندسی، این کمیت برای محاسبه بازده سیستمهای احتراقی مانند موتورهای خودرو یا کورهها به کار میرود.
مطالعات زیستمحیطی: آنتالپی سوختن به تحلیل میزان گرمای آزاد شده و تأثیرات زیستمحیطی (مانند تولید گازهای گلخانهای) کمک میکند.
نحوه محاسبه آنتالپی سوختن
آنتالپی سوختن را میتوان از طریق روشهای زیر محاسبه کرد:
آزمایش با کالریمتر: با استفاده از کالریمتر بمبی، گرمای آزاد شده در طی سوختن یک ماده اندازهگیری میشود.
قانون هس: با استفاده از آنتالپیهای تشکیل استاندارد (ΔH_f°) واکنشدهندهها و محصولات، میتوان آنتالپی سوختن را محاسبه کرد: [ Delta H_c^circ = sum Delta H_f^circ (text{محصولات}) – sum Delta H_f^circ (text{واکنشدهندهها}) ]
دادههای جدولی: مقادیر استاندارد آنتالپی سوختن برای بسیاری از مواد در جداول ترمودینامیکی موجود است.
مثالهای کاربردی
متان (CH₄): ΔH_c° = -890.3 kJ/mol (گرمای زیادی آزاد میکند، بنابراین سوخت محبوبی برای گرمایش است).
اتانول (C₂H₅OH): ΔH_c° = -1366.8 kJ/mol (به عنوان سوخت زیستی استفاده میشود).
گرافیت (C): ΔH_c° = -393.5 kJ/mol (سوختن کربن به CO₂).
نکات مهم
علائم آنتالپی: در واکنشهای اگزوترمیک، ΔH منفی است، زیرا گرما به محیط منتقل میشود.
وابستگی به حالت ماده: آنتالپی سوختن به حالت فیزیکی ماده (گاز، مایع یا جامد) بستگی دارد. به عنوان مثال، آنتالپی سوختن آب مایع و بخار آب متفاوت است.
ایمنی: در کاربردهای صنعتی، باید به خطرات ناشی از آزاد شدن انرژی زیاد در واکنشهای سوختن توجه داشت.
سوالات متداول درباره آنتالپی سوختن چیست؟
1. آنتالپی سوختن چیست؟
آنتالپی سوختن به مقدار انرژی گرمایی آزاد یا جذب شده در طی واکنش شیمیایی سوختن یک ماده با اکسیژن در شرایط استاندارد (25 درجه سانتیگراد و 1 اتمسفر) گفته میشود که معمولاً به صورت کیلوژول بر مول گزارش میشود.
2. چرا آنتالپی سوختن معمولاً منفی است؟
آنتالپی سوختن در واکنشهای اگزوترمیک (گرمازا) منفی است، زیرا انرژی به صورت گرما به محیط منتقل میشود، مانند سوختن متان که گرمای زیادی آزاد میکند.
3. چگونه میتوان آنتالپی سوختن را محاسبه کرد؟
آنتالپی سوختن را میتوان با استفاده از کالریمتر بمبی، قانون هس، یا دادههای استاندارد آنتالپی تشکیل واکنشدهندهها و محصولات محاسبه کرد.
4. کاربردهای آنتالپی سوختن چیست؟
این کمیت در ارزیابی کارایی سوختها، طراحی موتورها و سیستمهای گرمایشی، و تحلیل اثرات زیستمحیطی واکنشهای احتراقی کاربرد دارد.
5. تفاوت آنتالپی سوختن کامل و ناقص چیست؟
در سوختن کامل، ماده به دیاکسید کربن و آب تبدیل میشود و انرژی بیشتری آزاد میکند، اما در سوختن ناقص، محصولاتی مانند مونوکسید کربن یا دوده تشکیل شده و انرژی کمتری تولید میشود.
نتیجهگیری
آنتالپی سوختن یک معیار کلیدی برای درک انرژی آزاد شده در فرآیندهای احتراق است که در زمینههای علمی، صنعتی و زیستمحیطی کاربردهای گستردهای دارد. با استفاده از این مفهوم، میتوان کارایی سوختها را مقایسه کرد، سیستمهای انرژی را بهینهسازی نمود و اثرات زیستمحیطی را ارزیابی کرد.
گرد آوری:بخش علمی ستاره آبی



